研究背景:
臭氧是氧气的同素异形体,虽然是只由氧原子组成的单质,却是一个极性分子;这是由于成键的两个氧原子所表现出的电负性不相同,最终排列成V字型的分子。臭氧最为人熟知的是作为是地球的保护伞,阻隔了射向地球的的大部分紫外线,这保护了地球表面不受有害紫外线的影响。臭氧对紫外光的最大吸收在波长255nm,它能强烈吸收阳光中波长295nm以下、对人类和生物危害最大的短波紫外光,并能吸收大部分对生物有一定危害的波长280~320nm的中波紫外光(UV-B)。波长大于320nm的长波紫外光(UV-A)可通过臭氧层到达地球表面。
但是,一些专家发现因为气候变暖、多个行业产生的挥发性有机物(VOC)增多(例如汽修、加油站、餐饮、包装印刷等行业)、氮氧化物等污染物的排放,使得对流层的臭氧浓度有快速增大的趋势,会对人体健康产生有害影响。臭氧气味难闻,对眼睛和呼吸道有刺激作用,对肺功能也有影响,较高浓度的臭氧对植物也是有害的。臭氧亦可与含有不饱和有机化合物的建材和家居产品迅速发生反应,可导致染料褪色、图像层脱色、轮胎老化等问题。近地面的臭氧污染越来越严重基于我们的身体健康、生态文明建设和可持续发展战略,去除臭氧至关重要。

图1阳光照射到汽车尾气和工业排放化学物时,会形成臭氧
目前报道的臭氧去除方法有稀释法、热分解法、活性炭吸附法、化学吸附法等,但存在效率相对较低、能耗高、二次污染等问题。催化分解已成为去除臭氧最有效的方法。目前由于贵金属的高成本限制,过渡金属氧化物催化剂已成为最具吸引力的活性组分。其中含锰Mn的催化剂(如MnO2)具有良好的臭氧分解活性和较低的成本,是最有前途的一种。但其表面滞留氧的积累和较固定的价态限制了其催化效率。因此,非常需要开发比表面积更大、氧空位丰富、丰富的价态、活性优异的Mn基臭氧分解催化剂。
成果展示:
北京化工大学化学学院林彦军教授和刘闻笛副教授团队利用层状复合金属氢氧化物(LDHs)层板金属元素的可调控性、比表面积大、富含氧空位等特性,采用共沉淀法制备了锰基LDHs型臭氧分解催化剂,使其具有不同锰的平均氧化态(AOS)。其中Mg1.4Mn0.6Al-LDH,其锰含量仅为常用催化剂α-MnO2的四分之一,但其稳定后的臭氧催化分解效率却是α-MnO2的2.5
。下图是臭氧分解的机理图。
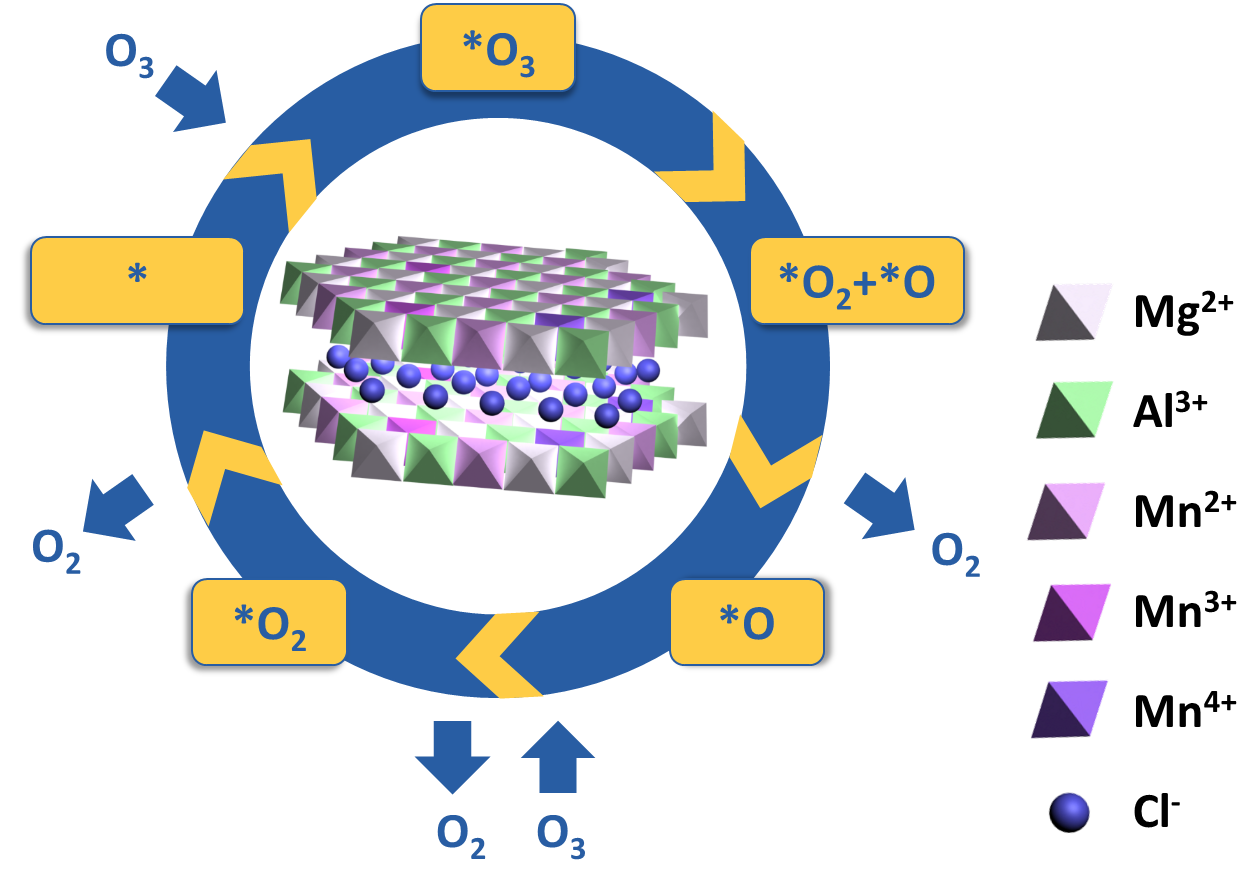
图2 MgMnAl-LDHs结构及表面臭氧分解步骤图
(1)价态调控
锰的价态对催化臭氧分解的影响很大,因为臭氧催化分解的机理主要是氧化还原步骤,而锰基催化剂的氧化还原活性也与Mn2+、Mn3+和Mn4+离子的存在有关。通过LDHs层板的可调节性比,制备了具有不同锰氧化态的MgMnAl-LDHs,其中每种水滑石中锰皆为混合价态。通过X射线光电子能谱分析(XPS)对所制备含锰的MgMnAl-LDHs样品中含有的元素及其化学价态进行了表征分析。探测光谱证实了MgMnAl-LDHs中存在Mn、Mg、Cl、Al和O。根据锰的Mn2+、Mn3+和Mn4+峰的积分面积,估算锰的平均氧化态(AOS)。结果表明,随着LDHs层Mn含量的增加,AOS依次为Mg1.4Mn0.6Al-LDH (2.3)、Mg1Mn1Al-LDH (2.7)和Mg0.6Mn1.4Al-LDH (3.1)。三种MgMnAl-LDHs的AOS均低于α-MnO2。
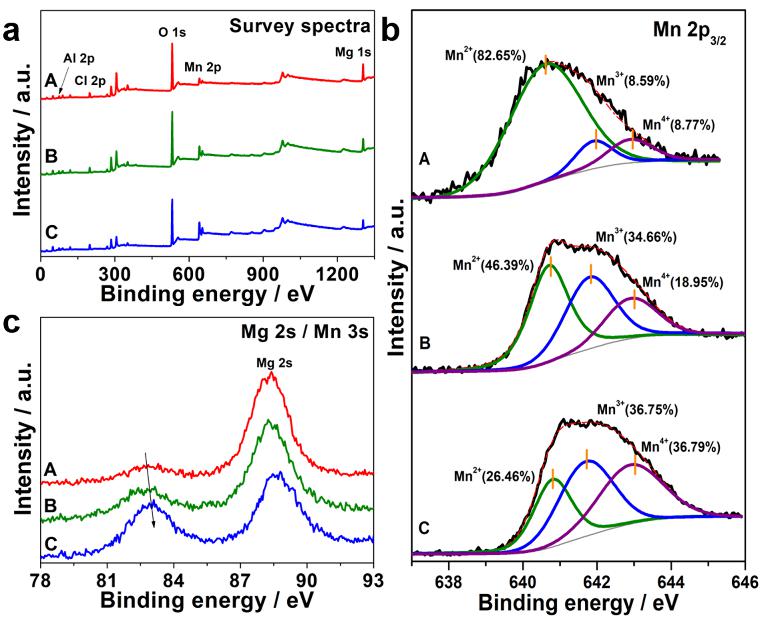
图3 三种MgMnAl-LDHs的XPS分析全谱,Mn 2p3/2图和3s图
在相对湿度(RH)为30%、入口臭氧浓度为30 ppm、空速840 Lg−1h−1的室温条件下,测定臭氧分解活性。所有含锰催化剂的初始催化活性均为100%,并在12小时后达到稳定的臭氧转化率。对于α-MnO2,由于表面捕获的氧的积累,催化活性急剧下降到25.2%左右。3种MgMnAl-LDHs在锰含量较低的情况下均具有高于α-MnO2的臭氧去除率,Mg1.4Mn0.6Al-LDH的活性高达72.9%。
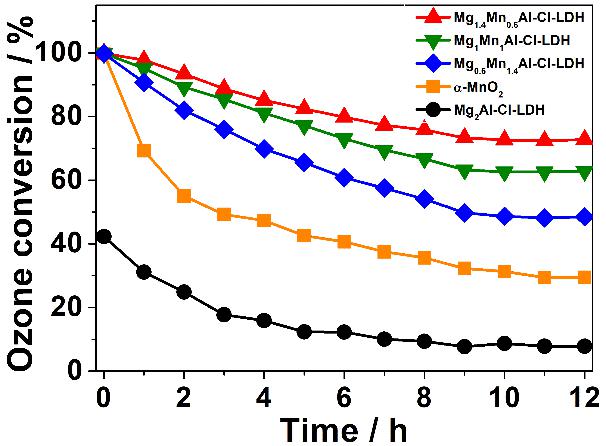
图4三种MgMnAl-LDHs、α-MnO2和Mg2Al-LDH的臭氧分解效率
(2)分解机理分析
研究发现锰的价态对臭氧分解有影响,但又因为锰自身的不稳定致使合成仅含有单一一个价态的锰基LDHs相当困难,因此需要建立模型进行密度泛函(DFT)计算以理论的形式研究锰的不同氧化价态对臭氧分解反应的影响。我们建造了三个分别含有+2、+3和+4价单一Mn氧化态的LDHs模型。利用密度泛函理论(DFT)计算进一步研究了Mn的价态对催化臭氧分解过程的影响。通过对所建模型在臭氧分解反应过程的吉布斯自由能研究,其中生成的氧气的脱附是反应的关键决速步骤。研究发现,Mn2+具有最佳的解吸能力,而Mn3+和Mn4+则有利于吸附的臭氧的解离。
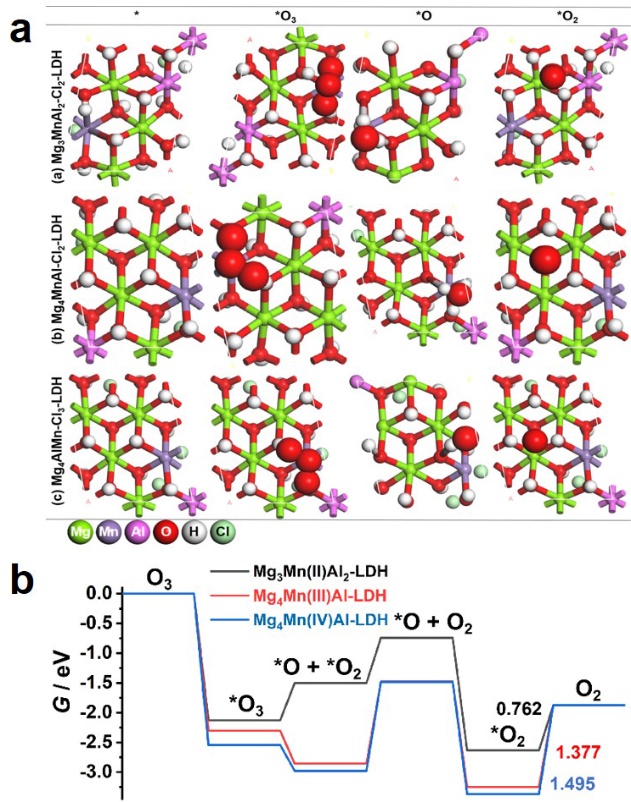
图5 a)不同MgMnAl-LDHs的臭氧分解反应中间体模型图,b) Mg3Mn(II)Al2-LDH,Mg4Mn(III)Al-LDH和Mg4Mn(IV)Al-LDH上臭氧分解反应的吉布斯自由能图速率确定步骤的吉布斯自由能变化(将MgMnAl-LDH上反应物的吉布斯自由能(* + 2O3)设置为0 eV)
Q1:什么是氧化态
氧化态又叫氧化数,它是以化合价学说和元素电负性概念为基础发展起来的一个化学概念,它在一定程度上标志着元素在化合物中的化合状态。在根据化合价的升降值和电子转移情况来配平氧化还原反应方程式时,除简单的离子化合物外,对于其他物质,往往不易确定元素的化合价数;对于一些结构复杂的化合物或原子团,更难确定它们在反应中的电子转移情况,因而难以表示物质中各元素所处的价态。
Q2:什么是共沉淀法
共沉淀法是水滑石合成的一种方法。原理是将含有不同价态的金属阳离子的盐溶液同相应的混合碱溶液按照一定配比混合形成母液,并在一定反应温度下晶化,通过离心洗涤等纯化程序制得LDHs晶体。基于共沉淀过程中的pH值变化又可以细分为恒定pH的双滴法和变化pH的单滴法两种。共沉淀法适用范围广,几乎所有的LDHs都可以通过选择不同的盐溶液和调整M2+/M3+的原始投料比利用共沉淀法进行制备。
Q3:DFT计算:
密度泛函理论(Density functional theory,缩写DFT)是一种研究多电子体系电子结构的方法。密度泛函理论在物理和化学上都有广泛的应用,特别是用来研究分子和凝聚态的性质,是凝聚态物理计算材料学和计算化学领域最常用的方法之一。
DFT方法的实质是将电子密度作为分子(原子)基态中所有信息的载体,而不是单个电子的波函数,从而使多电子体系转化为单电子问题进行求解。假设电子数目为N,则波函数中的变量数为3N,而密度泛函理论将变量数缩减到三个空间变量,这样既简化了计算过程,又可以确保计算精度。
Q4:速率控制步骤
又称为限速步骤,简称速控步,也译作决速步骤(rate-determining step (RDS))。速率控制步骤指的是如果在一个机理中,其中的一个基元步骤进行的速度远较其他速度慢,则该步骤决定总的反应速率。认识一个化学反应当中最慢的一个步骤的重要性在于能够有效率地改善整个化学反应的速度,从而达致更高的产率等。一个常用的比喻就是一条狭窄的水管——无论水流有多快,也无法改变水的流量。对于实际化学反应来说,并非每个化学反应都为基元反应,多数反应都由几个基本反应共同组成,其中反应速率最慢的反应为速率控制步骤,决定整个化学反应的进程。速率控制步骤就是影响整个化学反应速率那条水管。
北京化工大学科普实验中心



